 产业资讯
产业资讯
 癌度医学部
癌度医学部
 2019.11.15
2019.11.15
 8593
8593
今天,首款完全由我国自主研发、基于中国患者临床研究被FDA授予“突破性疗法”认定并受理上市申请的抗癌新药,百济神州的Zanubrutinib(泽布替尼)正式获美国FDA批准上市,用于治疗先前至少接受过一次治疗的成年套细胞淋巴瘤(R/R MCL)患者。
曾经,疗效好的抗癌药物都被默认由国外制药公司研发,在国外获批上市后多年才姗姗来迟来到中国;更有很多患者在等待中失去了最佳治疗时机。
曾经,美国FDA获批任何一款新药都是基于欧美患者的临床数据,即便是有中国患者参与的全球临床试验,所占的比例也很小。这些药物申请在中国上市,需要再招募中国患者开展临床研究。
作为新一代强效布鲁顿络氨酸激酶(BTK)抑制剂,泽布替尼一路走来,一次次刷新我们的期待:
✨ 2019年1月,FDA历史上第一次基于一项中国的临床研究来授予“突破性疗法认定”。
✨ 2019年8月,FDA第一次基于一项中国的临床研究受理新药上市的申请。
✨ 2019年11月15日,唯一获得FDA批准上市的我国完全自主研发的创新药。
它收获了太多的期待,也不负众望获得了历史性的突破。“这预示着我们中国的创新新药的研究确实进入了一个快车道或者一个新的平台,甚至进入了一个新的发展时期”,北京大学肿瘤医院朱军教授评价道。
1、亮眼的中国患者临床研究数据,敲开FDA的大门
2012年7月,北京大学肿瘤医院朱军教授牵头开启了泽布替尼的临床研究项目,经过长达4年的探索,泽布替尼在套细胞淋巴瘤(MCL)、慢性淋巴细胞性白血病(CLL)、华氏巨球蛋白血症(WM)中的疗效得到初步证实。
在2015年的美国血液学年会(ASH)上,泽布替尼的临床研究数据首次公布,对循环血液和淋巴结淋巴细胞均达到了完全持久的抑制作用,在套细胞淋巴瘤(MCL)、慢性淋巴细胞性白血病(CLL)、华氏巨球蛋白血症(WM)中展示了良好的疗效。
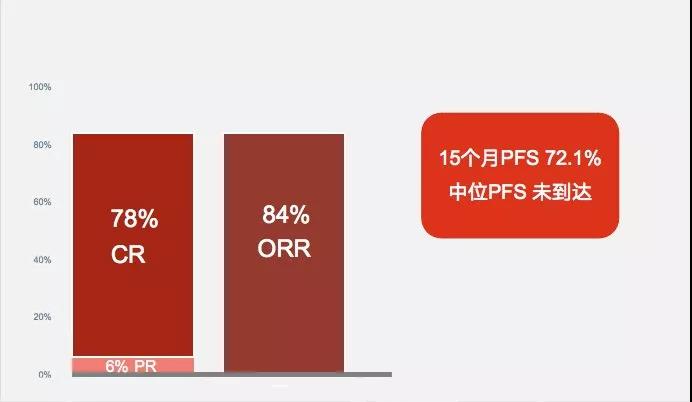
2019年6月的国际淋巴瘤大会(ICML)期间,北京大学肿瘤医院宋玉琴教授以口头报告的形式就泽布替尼用于治疗复发/难治性套细胞淋巴瘤患者进行了口头报告。这是一项单臂多中心关键性2期研究,共纳入86名复发或难治套细胞淋巴瘤患者(MCL)。
中位随访18.4个月,研究者评估的最佳ORR为84%,CR达到78%。较第一代BTK抑制剂提高疗效之外,泽布替尼的房颤、第二肿瘤、肿瘤溶解综合征的发生率均为0,再次证明了新一代BTK抑制剂有着更好的安全性。
基于泽布替尼在套细胞淋巴瘤临床试验中展现的积极结果,美国FDA授予其“突破性疗法”认定。这项认定的授予,被认为是中国创新药在走向全球的进程中迈出了重大一步,实现了从0到1的突破。
2、2018年两个适应症在国内获得优先审评,中国患者翘首以盼
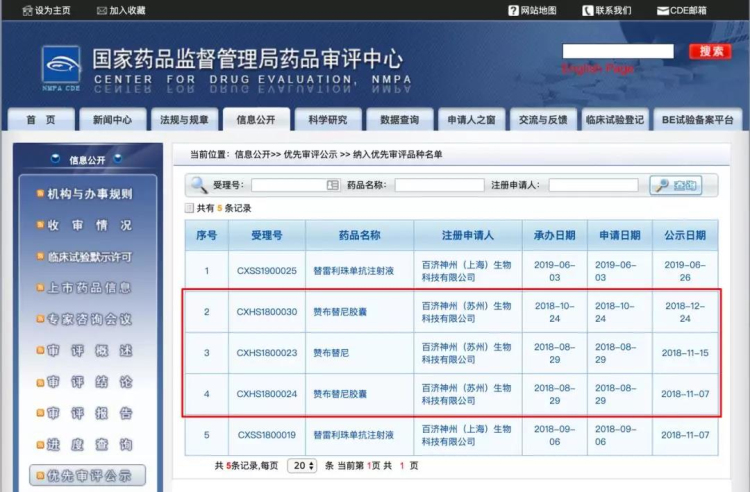
2018年8月和10月,百济神州分别向国家药品监督管理局(NMPA)提交了泽布替尼治疗复发/难治套细胞淋巴瘤(MCL)和慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)的上市申请。这两项申请都被药品审评中心(CDE)纳入了优先审评通道。
今天,泽布替尼于美国获批是中国创新药史上的突破,让我们一起期待它能在中国市场尽快获批,期待它造福更多国内外套淋患者,带来治疗的新希望!

 CPhI制药在线
CPhI制药在线
 2018.07.24
2018.07.24
 49700
49700

 艾美仕
艾美仕
 2018.07.09
2018.07.09
 34722
34722


 2014.03.11
2014.03.11
 31127
31127