 产业资讯
产业资讯
 镁信健康
镁信健康
 2021.01.15
2021.01.15
 3501
3501
到底什么是“血液病”?
“血液病”是原发于造血系统(原发)或者其他因素主要累及造血系统(继发),从而引起血液异常改变,以贫血、出血、发热、淋巴结、肝、脾大为特征的疾病。血液病范围广、病种多,临床表现也涉及全身多器官、多系统。
血液病可分为三大类:红细胞疾病、白细胞疾病、出血和血栓性疾病。临床常见疾病有白血病、再生障碍性贫血、骨髓增生异常综合征、血小板减少、多发性骨髓瘤、淋巴瘤、骨骼纤维化、血友病、地中海贫血、过敏性紫癜等。这些血液病中,有可以治愈的,也有较难治愈的。[1]

血液病的主要类型及临床常见疾病
过去,由于缺乏特定的治疗方法,一些类型的血液病被称为“不治之症”。近年来,随着医学研究的不断深入,血液病领域的新药迅速上市,或许可以改变血液病领域的治疗现状…
02
盘点“血液病”领域出现了哪些新药?
安适利 2020年5月获批
靶向创新药物安适利(注射用维布妥昔单抗)经国家药品监督管理局正式批准进入中国。获批的适应症为成人CD30阳性的复发或难治性系统性间变性大细胞淋巴瘤(sALCL)和复发或难治性经典型霍奇金淋巴瘤(cHL)的治疗。
安适利(注射用维布妥昔单抗)由靶向CD30的单克隆抗体连接一种抑制微管的细胞毒药物(单甲基澳瑞他汀E,MMAE)组成,可在血液中稳定存在,精准杀灭表达CD30的肿瘤细胞[2]。该药物临床使用经验丰富,真实世界循证依据充分,疗效久经验证。此前,美国国家综合癌症网络(NCCN)指南已将维布妥昔单抗推荐为标准治疗药物[3,4],中国临床肿瘤学会(CSCO)指南亦将其纳入临床选择范围[5]。
安适利(注射用维布妥昔单抗)在中国的获批是基于三项临床研究,SG035-0004、SG035-0003和C25007的数据。
其中,在SG-035-0004研究中,针对复发或难治性间变大细胞淋巴瘤,58例患者中97%的复发或难治性系统性间变性大细胞淋巴瘤患者可实现肿瘤缩小[6],其5年生存率提高至60%[7];
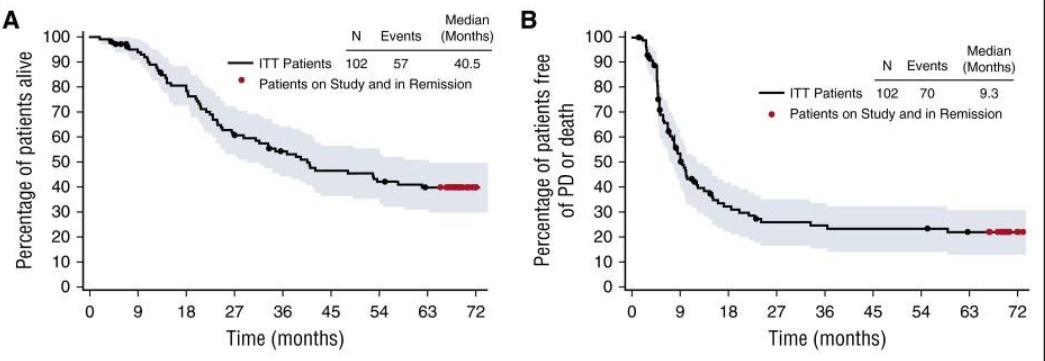
SG-035-0004研究
在SG035-0003研究中,94%的复发或难治性经典型霍奇金淋巴瘤的患者可实现肿瘤缩小[8],其中位总生存期(OS)从历史27.6个月提升至40.5个月[9];
在C25007研究中,在既往至少接受一次化疗方案且开始维布妥昔单抗治疗时不适合进行干细胞移植(SCT)或多药化疗的复发或难治性经典型霍奇金淋巴瘤患者(n=60)中,客观缓解率(ORR)为50%(95% CI,37: 63%)[10]。
兆珂 2019年7月获批
2019年7月5日,兆珂(达雷妥尤单抗注射液)获得国家药品监督管理局批准,用于单药治疗复发和难治性多发性骨髓瘤成年患者,患者既往接受过包括蛋白酶体抑制剂和免疫调节剂的治疗且最后一次治疗时出现疾病进展。
此前,凭借创新作用机制和显著临床获益,全球首个CD38单克隆抗体兆珂于2018年12月获国家药品监督管理局授予“优先审评”资格,并于2019年4月获得“特殊审批”资格。作为中国首个获批的CD38单克隆抗体靶向药物,这一革新的方案有望再定义国内多发性骨髓瘤的治疗。
兆珂的获批基于两项国际临床研究(MMY2002 和GEN501)以及一项中国临床研究(MMY1003)数据。研究显示,对于复发和难治性多发性骨髓瘤患者,兆珂单药治疗可显著改善疗效,且安全性可控。
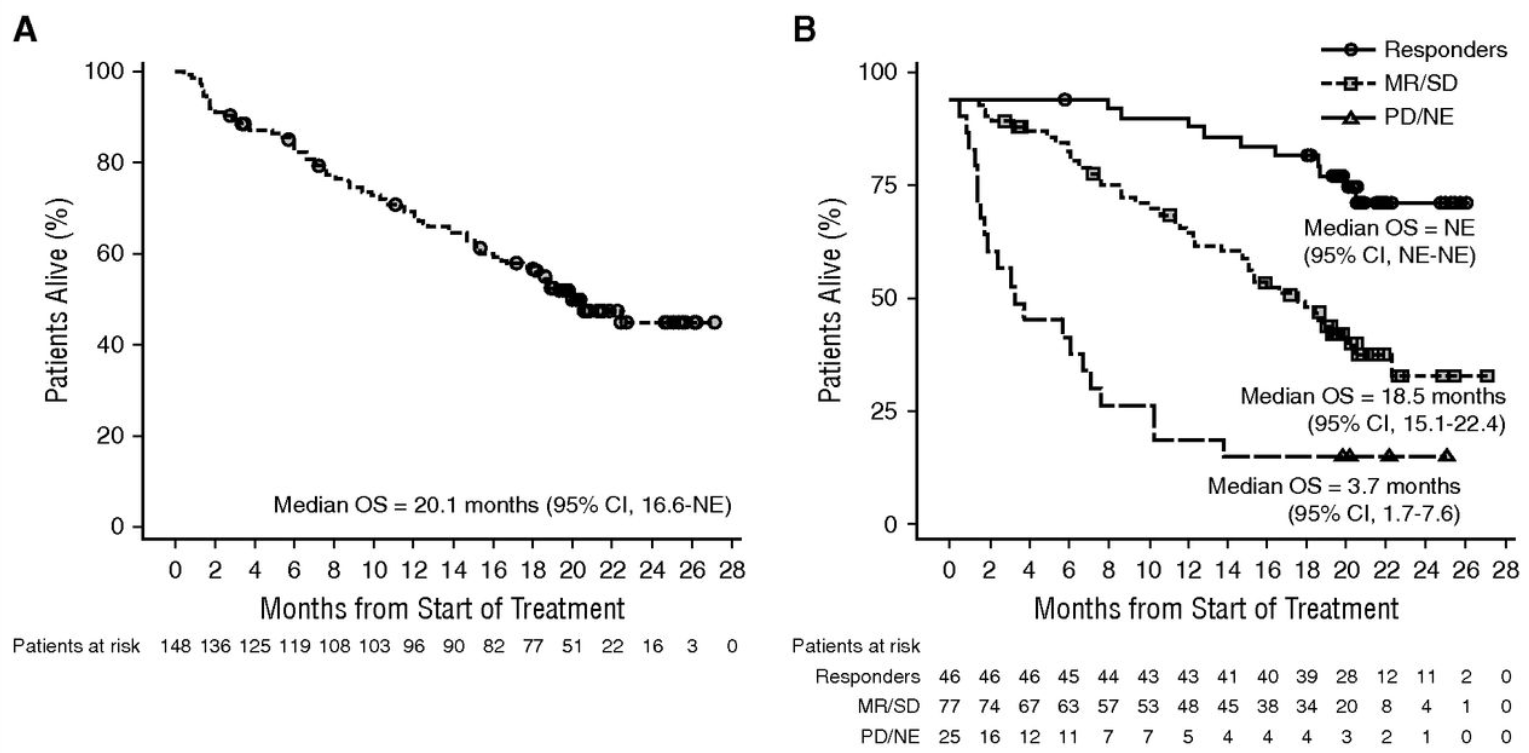
三项研究汇总数据
两项国际临床研究汇总分析结果显示,既往接受过多线治疗的多发性骨髓瘤患者使用16mg/kg达雷妥尤单抗单药治疗,中位总生存期延长近20个月,83%患者最佳疗效评估为疾病稳定或更好,总缓解率为31%[11]。此外,未发生与兆珂相关的治疗期间不良事件导致中断治疗 [12,13]。
在中国开展的开放性、非随机化的 I 期研究MMY1003的结果显示,兆珂单药用于既往接受至少2线治疗的复发或难治性多发性骨髓瘤中国患者的临床疗效和安全性与全球临床研究基本一致 [14]。
亿珂 2017年8月获批
2017年8月,亿珂在中国获批用于既往至少接受过一种治疗的慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者以及既往至少接受过一种治疗的小淋巴细胞淋巴瘤患者的治疗。
CLL/SLL一线治疗适应症的申请获得了国家药品监督管理局授予的“优先审批”资格,其获批使亿珂成为国内首个CLL/SLL一线治疗的口服靶向疗法,可以帮助更多患者更早地获益于这一创新疗法,从而提高生活质量。
其获批基于一项针对269位年龄65岁以上的慢性淋巴细胞白血病/小淋巴细胞淋巴瘤初治患者开展的随机、多中心、开放性研究RESONATE-2(PCYC-1115)的结果[15]。
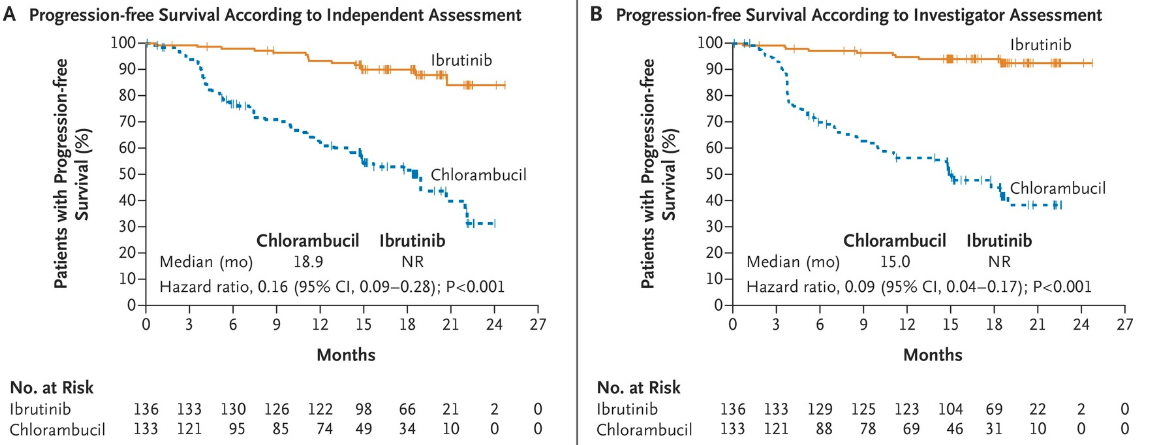
RESONATE-2研究的PFS数据
该研究显示,对比苯丁酸氮芥组,伊布替尼组的无进展生存期(主要终点)显著延长。
百泽安 2019年12月获批
2019年于12月27日获得国家药品监督管理局批准,百泽安获批用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤患者。
百泽安是百济神州继自主研发的BTK抑制剂BRUKINSA(泽布替尼)获得美国食品药品监督管理局上市批准后,首款在国内获批的自主研发抗癌新药。
此次百泽安获得中国国家药品监督管理局批准是基于包括一项在中国开展的单臂、多中心的关键性2期临床试验BGB-A317-203的临床研究结果。[16]
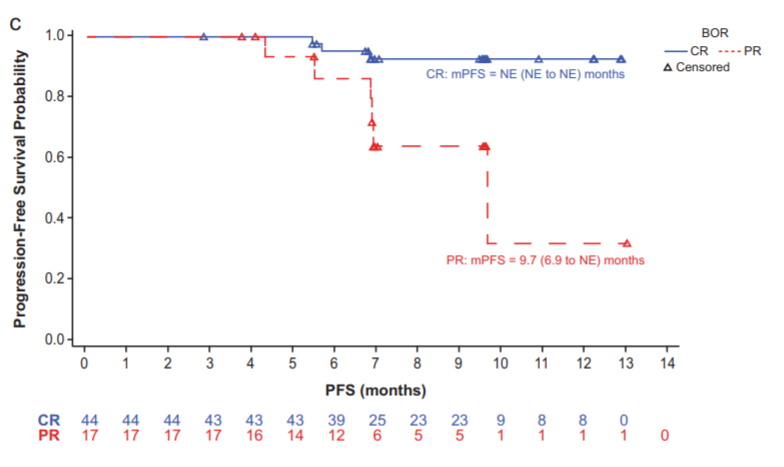
BGB-A317-203研究的PFS数据
无论是CR组还是PR组,其对经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤患者均疗效显著。
美罗华 2019年12月获批
2019年12月,美罗华(利妥昔单抗)获得中国国家药品监督管理总局(NMPA)正式批准,用于初治滤泡性淋巴瘤(FL)患者经利妥昔单抗联合化疗后达完全或部分缓解后的单药维持治疗,及与氟达拉滨和环磷酰胺(FC)联合治疗先前未经治疗或复发性/难治性慢性淋巴细胞白血病(CLL)患者。
本次中国国家药品监督管理局批准美罗华用于FL单药维持治疗适应症主要基于PRIMA研究。[17]
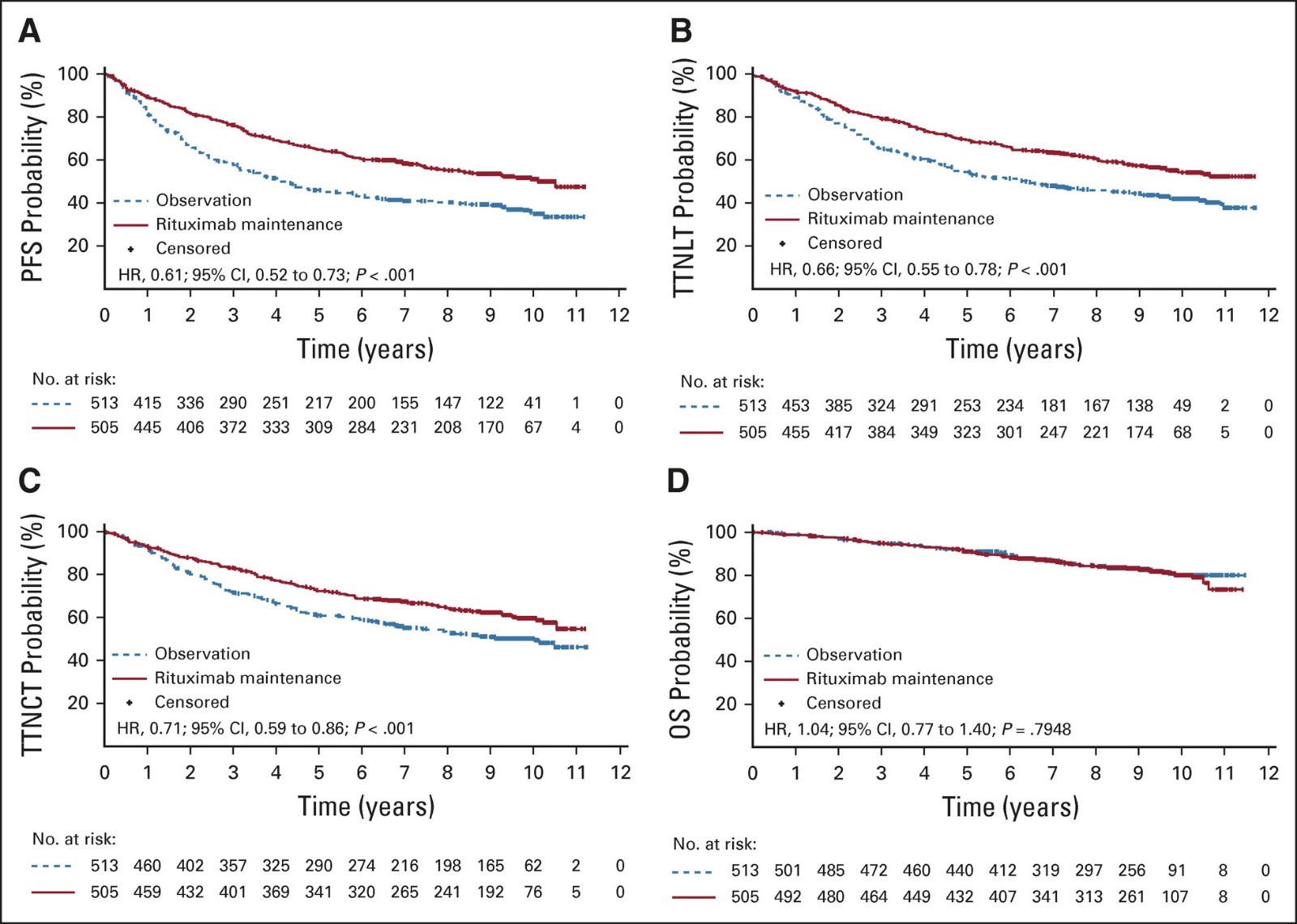
PRIMA研究的PFS数据
分析结果显示:使用美罗华维持治疗的患者,82%在两年内没有出现疾病进展或恶化(PFS),和观察组相比,美罗华维持治疗可显著降低疾病进展风险达50%。随访9.8年结果显示,进行维持治疗的患者中,疾病无进展时间(PFS)中位值为10.5年,观察组仅为4.1年。美罗华维持组有超过半数的患者无疾病进展(疾病进展风险降低38%),或者不需要新的抗淋巴瘤治疗(再次治疗风险降低33%)。

 CPhI制药在线
CPhI制药在线
 2018.07.24
2018.07.24
 49668
49668

 艾美仕
艾美仕
 2018.07.09
2018.07.09
 34702
34702


 2014.03.11
2014.03.11
 31116
31116