 研发追踪
研发追踪
 医药魔方Info
医药魔方Info
 2022.09.26
2022.09.26
 2697
2697
9月21日,礼来宣布,Retevmo(selpercatinib,塞尔帕替尼)新适应症获FDA加速批准,用于治疗转染重排(RET)基因融合的局部晚期或转移性实体瘤患者,这些患者在接受前期系统性治疗后发生疾病进展,或没有其它满意的替代治疗选择。这是全球首个且唯一一个不限癌种用于治疗RET基因融合实体瘤的RET抑制剂。

此外,FDA还拓宽了selpercatinib治疗非小细胞肺癌的适应症范围,纳入局部晚期疾病患者,并将2020年5月对NSCLC的加速批准转为完全批准。
本次FDA的批准主要基于I/II期LIBRETTO-001试验的ORR和DoR结果。研究纳入了初治患者和经治的各种晚期实体肿瘤患者,包括RET融合阳性的NSCLC、RET突变的MTC、RET融合阳性的甲状腺癌以及其它RET改变的实体肿瘤,共702例。
在41名RET阳性实体瘤受试者中的结果如下,客观缓解率为44%,中位缓解持续时间为24.5个月,67%的患者缓解持续时间超过6个月。

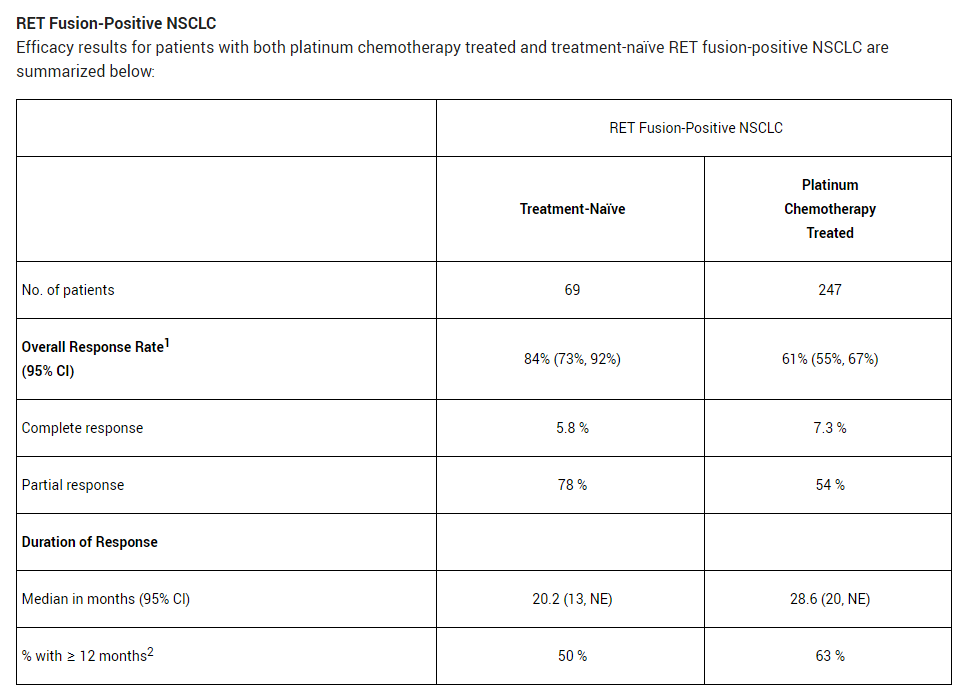
在初治或接受含铂治疗的RET融合阳性NSCLC患者中结果如下,ORR分别为84%和61%,中位缓解持续时间分别为20.2个月和28.6个月,缓解持续时间超过12个月的患者比例分别为50%和63%。
RET融合和突变发生在多种肿瘤类型中,包括肺癌、甲状腺癌以及其他一些肿瘤类型中。据估计,RET基因融合在NSCLC患者中的发生率约为1%~2%,在甲状腺乳头状癌(占所有甲状腺癌的85%左右)中的发生率为10%~20%,在甲状腺髓样癌中的发生率为60%左右。

Selpercatinib是Loxo Oncology开发的一种高选择性和有效的转染重排基因(RET)抑制剂。2019年1月,礼来花费80亿美元收购Loxo Oncology公司,从而获得了该靶向疗法。
2020年5月8日,FDA加速批准selpercatinib上市,成为首个获批靶向RET的肿瘤疗法,用于治疗成人转移性RET融合阳性非小细胞肺癌(NSCLC)、成人及12岁以上儿童需要全身治疗的晚期或转移性RET突变髓样甲状腺癌(MTC)和需要全身治疗且放射性碘耐受(如适当)的晚期或转移性RET融合阳性甲状腺癌患者的疗法。2021年8月,中国药监局受理了selpercatinib用于上述适应症的新药上市申请,并授予优先审评资格。
2022年3月,礼来和信达生物达成协议,授予后者在中国大陆进口、销售、推广和分销雷莫西尤单抗和Selpercatinib获批后独家商业化权利。Selpercatinib在2021年的全球销售额为1.147亿美元,相比2020年(0.366亿美元)有较大提升。2022年上半年,该药物的销售额为0.868亿美元。

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34358
34358

 医药地理
医药地理
 2018.10.22
2018.10.22
 18825
18825

 医谷
医谷
 2019.03.18
2019.03.18
 18774
18774