 产业资讯
产业资讯
 药明康德
药明康德
 2024.04.15
2024.04.15
 117
117
在2023年,共有49种创新药物(不含疫苗和基因疗法)在美国、欧盟、日本等国家和地区获得批准上市。近期,《自然》子刊Nature Reviews Drug Discovery发表了一篇文章,详细介绍了其中12种创新靶点以及相应的9种药物,这些靶点之前未在批准药物中使用过。值得注意的是,在这9种药物中,小分子药物占据了5种,超过半数;抗体药物有2种;反义寡核苷酸和siRNA药物各占1种。这表明小分子药物的开发创新依然在持续进步。本文还将结合公开资料,探讨这些药物的特点及其采用的创新机制。
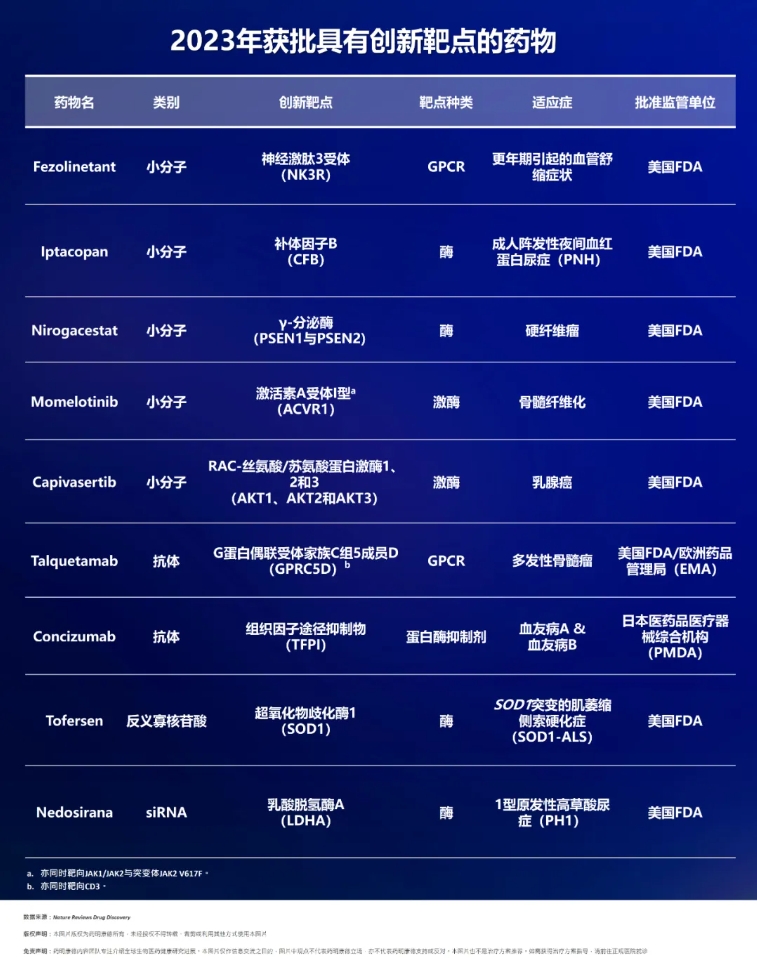
▲2023年获批药物中,9款具有创新靶点的药物(图片来源:药明康德内容团队根据参考资料[1]制表)
药物:fezolinetant(商品名:Veozah)
研发机构:安斯泰来(Astellas Pharma)
靶点:神经激肽3受体(NK3R)
适应症:更年期引起的血管舒缩症状
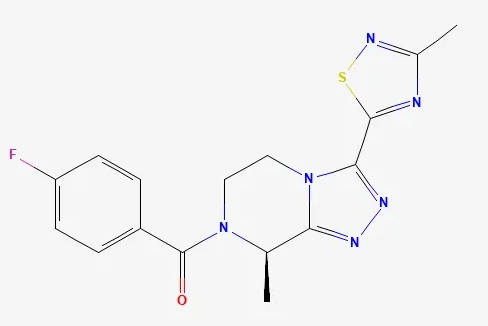
▲Fezolinetant的结构式(图片来源:PubChem)
Fezolinetant是一种神经激肽3受体拮抗剂,神经激肽3受体参与大脑调节体温的机制。Fezolinetant不是一种激素,而是靶向引起更年期潮热的神经活动。FDA曾授予fezolinetant优先审评资格,2023年5月,美国FDA批准fezolinetant上市,用于治疗由更年期引起的中度至重度血管舒缩症状。根据新闻稿,fezolinetant是首款获得FDA批准用以治疗此类患者的非激素类NK3R拮抗剂。
药物:iptacopan(商品名:Fabhalta)
研发机构:诺华(Novartis)
靶点:补体因子B(CFB)
适应症:成人阵发性夜间血红蛋白尿症(PNH)
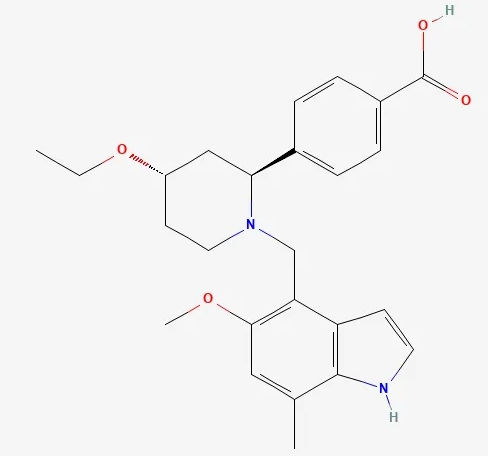
▲Iptacopan的结构式(图片来源:PubChem)
Iptacopan是一种针对补体因子B的抑制剂,补体因子B在免疫系统的替代补体途径中起作用,全面控制血管内外的红细胞(RBC)破坏。Iptacopan可能在治疗多种替代通路功能异常导致的疾病的同时,不影响其它补体通路介导的对微生物入侵的免疫反应,降低患者受到感染的风险。美国FDA在2023年12月批准Iptacopan上市,用于治疗成人阵发性夜间血红蛋白尿症。新闻稿指出,该疗法是治疗PNH的首个口服单药疗法。
药物:nirogacestat(商品名:Ogsiveo)
研发机构:SpringWorks Therapeutics
靶点:γ-分泌酶(PSEN1与PSEN2)
适应症:硬纤维瘤
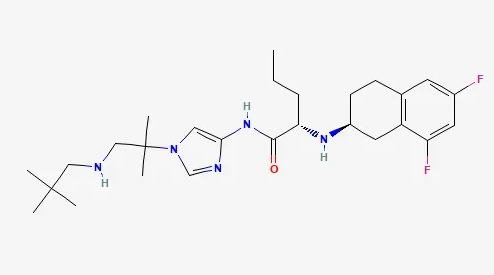
▲Nirogacestat的结构式(图片来源:PubChem)
Nirogacestat是一款口服特异性γ-分泌酶小分子抑制剂,γ-分泌酶能够切割多种跨膜蛋白复合体(其中包括Notch蛋白),防止其通过蛋白酶解活化。而Notch蛋白被认为能够激活导致硬纤维瘤生长的信号通路。
美国FDA在2023年11月批准nirogacestat片剂用于需要全身治疗的进展性硬纤维瘤成人患者。根据FDA新闻稿,nirogacestat是首个被批准用于治疗硬纤维瘤患者的药物,硬纤维瘤是一种罕见的软组织肉瘤亚型。
药物:capivasertib(商品名:Truqap)
研发机构:阿斯利康(AstraZeneca)
靶点:RAC-丝氨酸/苏氨酸蛋白激酶1、2和3(AKT1、AKT2和AKT3)
适应症:乳腺癌
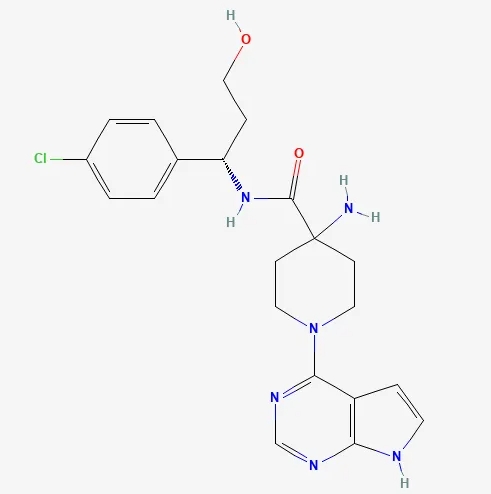
▲Capivasertib的结构式(图片来源:PubChem)
Capivasertib是一款具选择性、靶向3种AKT激酶异形体(AKT1/2/3)的腺苷三磷酸(ATP)竞争性抑制剂,具有潜力治疗携带PI3K/AKT/PTEN信号通路变异的肿瘤。
在临床试验中,在氟维司群的基础上联合capivasertib能显著改善内分泌疗法芳香化酶抑制剂(AI)治疗(联合或不联合CDK4/6抑制剂)后疾病进展的HR阳性/HER2阴性(HR+/HER2-)晚期乳腺癌患者的无进展生存期(PFS)。此药品在2023年1月获FDA授予快速通道资格,随后在2023年11月17日获得FDA批准上市,与氟维司群联合使用,治疗HR阳性、HER2阴性的晚期或转移性乳腺癌成年患者。这些患者通过FDA认可的检测显示携带一个或多个PIK3CA/AKT1/PTEN变异,并且在完成辅助治疗后12个月内疾病复发,或者转移性疾病经历过至少一种内分泌治疗方案后出现进展。
药物:momelotinib(商品名:Ojjaara)
研发机构:GSK
靶点:激活素A受体I型(ACVR1),亦同时靶向JAK1/JAK2与突变体JAK2 V617F
适应症:骨髓纤维化
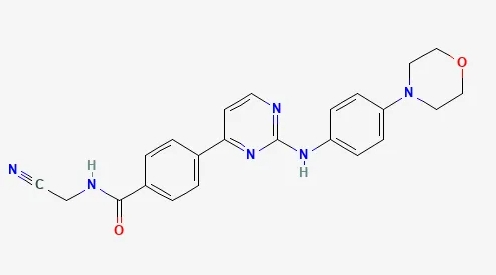
▲Momelotinib的结构式(图片来源:PubChem)
Momelotinib是一种小分子抑制剂,具有独特的作用机制,可抑制三条关键信号通路:ACVR1、JAK1和JAK2。抑制JAK1和JAK2可改善体征和脾肿大,这是骨髓纤维化的临床特征之一。此外,抑制ACVR1会导致循环中的铁调素减少,从而改善贫血症状。
2023年9月,momelotinib被批准用于治疗中度或高风险骨髓纤维化,包括原发性骨髓纤维化或继发性骨髓纤维化(真性红细胞增多症后和原发性血小板增多症后)成人贫血患者。它是第四种被批准用于治疗骨髓纤维化的JAK1/2抑制剂,也是第一种同时可抑制ACVR1的JAK1/2抑制剂,可促进红细胞生成以改善贫血。
药物:talquetamab(商品名:Talvey)
研发机构:强生(Johnson & Johnson)
靶点:G蛋白偶联受体家族C组5成员D(GPRC5D)和CD3
适应症:多发性骨髓瘤
Talquetamab是一种“first-in-class”双特异性T细胞结合抗体,可结合T细胞表面表达的CD3受体和GPRC5D,促进T细胞介导的癌细胞杀伤。GPRC5D是一种新型多发性骨髓瘤靶标,在多发性骨髓瘤细胞和非恶性浆细胞以及一些健康组织如皮肤和舌上皮细胞表面高度表达。
2021年5月和2021年8月,Talvey分别被美国FDA和欧盟委员会授予治疗多发性骨髓瘤的孤儿药资格。Talvey也于2022年6月获得美国FDA授予的突破性疗法认定,用于既往接受过至少4线治疗(包括蛋白酶体抑制剂、免疫调节剂和抗CD38抗体)的复发性或难治性多发性骨髓瘤成人患者的治疗,并于2023年8月获美国FDA加速批准用于治疗该适应症。
药物:Concizumab(商品名:Alhemo)
研发机构:诺和诺德(Novo Nordisk)
靶点:组织因子途径抑制物(TFPI)
适应症:血友病A和血友病B
Concizumab是一款靶向TFPI的单克隆抗体,通过与TFPI的Kunitz-2结构域结合,阻止TFPI与活化的凝血因子X结合从而防止凝血因子X的活性被抑制。TFPI是体内一种阻止血液凝集的蛋白,借由靶向TFPI,concizumab协助抗凝血酶的生产,进而促进血液凝集并避免出血。
之前所公布的explorer7临床3期试验数据显示,试验达成主要目标,即接受concizumab预防性疗法的血友病患者需治疗的自发与创伤型出血降低86%。2023年2月,日本监管机构批准了concizumab的上市申请,用于治疗血友病A和血友病B。
药物:tofersen(商品名:Qalsody)
研发机构:渤健(Biogen),Ionis Pharmaceuticals
靶点:超氧化物歧化酶1(SOD1)
适应症:SOD1突变的肌萎缩侧索硬化症(SOD1-ALS)
肌萎缩侧索硬化(ALS)是一种进行性神经退行性疾病,影响大脑和脊髓中的神经细胞,许多基因被认为与此疾病有关,其中SOD1-ALS患者约占了2%。这些患者中大部分疾病进展迅速,发病后甚至无法活过1年。
Tofersen是一种反义寡核苷酸药物,它可以与编码SOD1蛋白的mRNA结合,造成其被核糖核酸酶RNase-H降解,进而减少突变的SOD1蛋白生成。2023年4月,tofersen被FDA批准用于治疗SOD1突变的ALS患者。这是FDA批准治疗遗传性ALS的首款疗法。这也是首款基于生物标志物加速批准的ALS疗法。
药物:nedosiran(商品名:Rivfloza)
研发机构:诺和诺德
靶点:乳酸脱氢酶A(LDHA)
适应症:1型原发性高草酸尿症(PH1)
Nedosiran是一种每月一次、皮下注射的RNAi疗法。可通过与表达LDHA的mRNA结合来抑制该蛋白表达。LDHA是导致草酸盐过度生成的关键代谢酶,降低LDHA的水平可以有效阻止草酸盐的产生,进而缓解肾脏相关症状。Nedosiran最初由Dicerna Pharmaceuticals开发,诺和诺德于2021年收购该公司并获得该疗法权益。
2023年10月,Nedosiran获得了FDA的批准,用于降低9岁及以上儿童和成人PH1患者的尿草酸水平,这些患者的肾功能相对良好。根据新闻稿,Rivfloza是诺和诺德所开发的首款获批RNAi疗法。
以上9种在去年获批的药物引入了创新靶点,这一突破不仅体现了医药行业在追求创新和知识拓展方面的不懈努力,也为现有治疗方法的扩充做出了贡献。回顾这些创新成果,医药行业应继续保持对研发的持续投入和探索,以期满足更多尚未得到解决的医疗需求,进而根本性地改变疾病治疗的面貌。

 CPhI制药在线
CPhI制药在线
 2018.07.24
2018.07.24
 49740
49740

 艾美仕
艾美仕
 2018.07.09
2018.07.09
 34753
34753


 2014.03.11
2014.03.11
 31146
31146